Khả năng gây bệnh và độc lực của ba kiểu gen Circovirus type 2
Khả năng gây bệnh và độc lực của ba kiểu gen Circovirus type 2 (PCV2) (a, b và d) ở heo bị gây nhiễm riêng lẻ với PCV2 và gây nhiễm kép Mycoplasma hyopneumoniae và PCV2

Tóm tắt
Mục tiêu của nghiên cứu này là so sánh độc lực của ba kiểu gen PCV2 khác nhau (PCV2a, PCV2b và PCV2d) ở heo bị gây nhiễm một trong ba kiểu gen PCV2 này so với heo bị gây nhiễm kép Mycoplasma hyopneumoniae và PCV2.
Heo bị gây nhiễm M. hyopneumoniae trong khí quản lúc 4 tuần tuổi, sau đó vào lúc 6 tuần tuổi tiếp tục bị gây nhiễm trong mũi với một trong ba kiểu gen PCV2. Gây nhiễm kép với hai mầm bệnh ở heo gây khó thở vừa và nặng, mệt mỏi và giảm tăng trọng ở heo với bất kỳ kiểu gen PCV2 so với heo chỉ bị gây nhiễm đơn PCV2.
Nồng độ PCV2d trong máu và mức độ nghiêm trọng của các tổn thương bạch huyết, và kháng nguyên PCV2 trong các tổn thương bạch huyết cao hơn đáng kể ở heo bị gây nhiễm kép M. hyopneumoniae/PCV2d khi so sánh với tất cả các nhóm bị gây nhiễm kép khác. Không có sự khác biệt đáng kể về nồng độ PCV2 trong máu và sự hình thành các tổn thương bạch huyết liên quan đến PCV2 giữa các nhóm heo bị gây nhiễm đơn PCV2a, PCV2b hoặc PCV2d. Kết quả của nghiên cứu này đã chứng minh rằng M. hyopneumoniae làm tăng khả năng nhân lên của PCV2d nhiều hơn so với các kiểu gen PCV2 khác, được xác định bằng mức độ nghiêm trọng của tổn thương bạch huyết.
Keywords: Mycoplasma hyopneumoniae, bệnh liên quan porcine circovirus, porcine circovirus type 2, kiểu gien PCV2
1. Đặt vấn đề
PCV2 và Mycoplasma hyopneumoniae là hai trong số các mầm bệnh chính ở heo và là nguyên nhân gây thiệt hại kinh tế to lớn cho người chăn nuôi heo [1,2]. PCV2 rất phổ biến trên toàn thế giới [3], là tác nhân gây bệnh chính của bệnh liên quan đến PCVAD, với nhiều biểu hiện lâm sàng do nhiễm PCV2, như hội chứng còi cọc sau cai sữa (PMWS), viêm phổi do PCV2, rối loạn sinh sản và bệnh đường ruột [4]. M. hyopneumoniae là tác nhân chính gây bệnh viêm phổi lưu nhiễm, một bệnh hô hấp mãn tính, phổ biến và đặc trưng bởi sự giảm tăng trọng trung bình hàng ngày và giảm hiệu quả chuyển hóa thức ăn, đồng thời làm tăng nguy cơ nhiễm trùng thứ cấp ở heo [5].
PCVAD được coi là một bệnh đa yếu tố với biểu hiện lâm sàng do nhiều tác nhân gây bệnh đồng nhiễm [3]. Nhiễm PCV2 là một trong những yếu tố cần thiết, nhưng không phải lúc nào cũng đủ để tự gây ra PCVAD. M. hyopneumoniae thường được ghi nhận là tác nhân đồng nhiễm trong PCVAD [2,6] và đã được chứng minh là làm tăng tình trạng bệnh lý liên quan đến PCV2 khi heo nhiễm M. hyopneumoniae hai tuần trước khi nhiễm PCV2 [7]. PCV2a là kiểu gen duy nhất được nghiên cứu trước đây trong mô hình đồng nhiễm với M. hyopneumoniae [7]. PCV2a, PCV2b và PCV2d hiện vẫn là các kiểu gen phổ biến nhất đang lưu hành trong đàn heo trên toàn thế giới [8]. Do đó, mục tiêu của nghiên cứu này là so sánh độc lực và khả năng gây bệnh của PCVAD do heo đồng nhiễm với từng kiểu gen trong ba kiểu gen của PCV2 và M. hyopneumoniae.
2. Kết quả
2.1 Lâm sàng
Tất cả heo bị gây nhiễm đơn PCV2 đều biểu hiện các dấu hiệu của bệnh hô hấp ở mức tối thiểu và vẫn bình thường về mặt lâm sàng. Trong khi đó, dấu hiệu lâm sàng được quan sát thấy ở tất cả heo bị gây nhiễm kép M. hyopneumoniae/PCV2a, M. hyopneumoniae/PCV2b hoặc M. hyopneumoniae/PCV2d. Bất kể kiểu gen PCV2 là gì, heo bị gây nhiễm kép M. hyopneumoniae/PCV2 đều phát triển tình trạng suy hô hấp nghiêm trọng sau 7 ngày và kéo dài đến 21 ngày kể từ khi gây nhiễm. Điểm bệnh lý hô hấp ở sau 7 ngày và đến 21 ngày kể từ khi gây nhiễm ở heo bị gây nhiễm kép M. hyopneumoniae/PCV2a, M. hyopneumoniae/PCV2b hoặc M. hyopneumoniae/PCV2d cao hơn đáng kể (p < 0,05) so với heo bị gây nhiễm đơn PCV2a, PCV2b, hoặc PCV2d và của heo đối chứng âm tính (Hình 1). Tất cả heo bị gây nhiễm đều bị xù lông, bất kể kiểu gen PCV2. Ở heo đối chứng âm không ghi nhận được dấu hiệu lâm sàng nào trong suốt thời gian thí nghiệm.
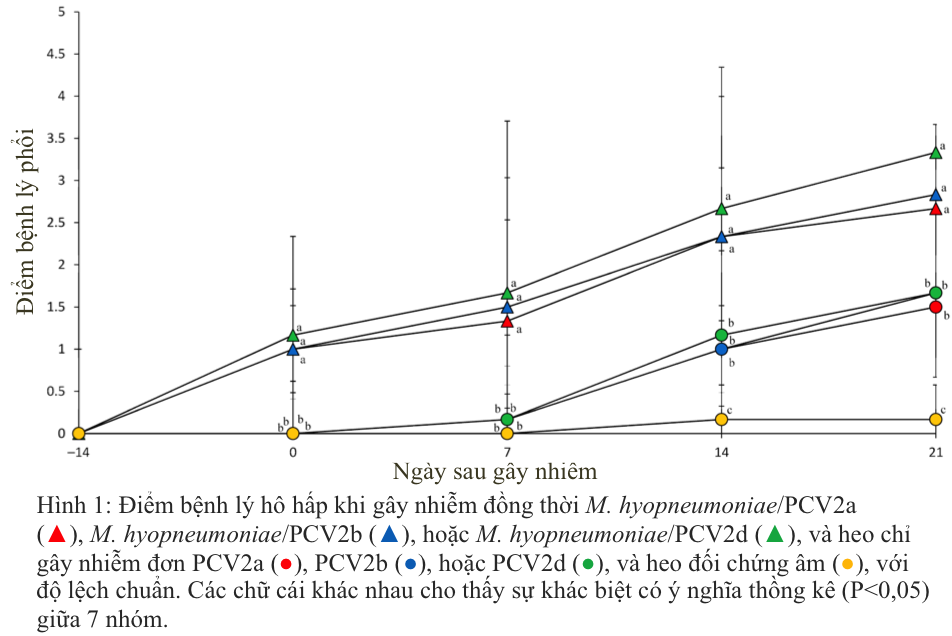
Hình 1: Điểm bệnh lý hô hấp khi gây nhiễm đồng thời M. hyopneumoniae/PCV2a (▲), M. hyopneumoniae/PCV2b (▲), hoặc M. hyopneumoniae/PCV2d (▲), và heo chỉ gây nhiễm đơn PCV2a (●), PCV2b (●), hoặc PCV2d (●), và heo đối chứng âm (●), với độ lệch chuẩn. Các chữ cái khác nhau cho thấy sự khác biệt có ý nghĩa thồng kê (P<0,05) giữa 7 nhóm.
Không có sự khác biệt thống kê về trọng lượng cơ thể trung bình giữa các lô khi bắt đầu thí nghiệm (heo 28 ngày tuổi). Ở 63 ngày tuổi (21 ngày sau gây nhiễm), heo bị gây nhiễm kép M. hyopneumoniae/PCV2a, M. hyopneumoniae/PCV2b và M. hyopneumoniae/PCV2d có trọng lượng cơ thể trung bình thấp hơn đáng kể (p < 0,05) so với heo bị gây nhiễm đơn PCV2a, PCV2b hoặc PCV2d, cũng như heo đối chứng âm. Heo bị gây nhiễm kép M. hyopneumoniae/PCV2a, M. hyopneumoniae/PCV2b hoặc M. hyopneumoniae/PCV2d có mức tăng trọng trung bình hàng ngày thấp hơn đáng kể (p < 0,05) (ADWG; gam/heo/ngày) trong khoảng thời gian từ 28 đến 63 ngày tuổi so với heo bị gây nhiễm đơn PCV2a, PCV2b, PCV2d hoặc đối chứng âm (Bảng 1).

- Xét nghiệm ELISA
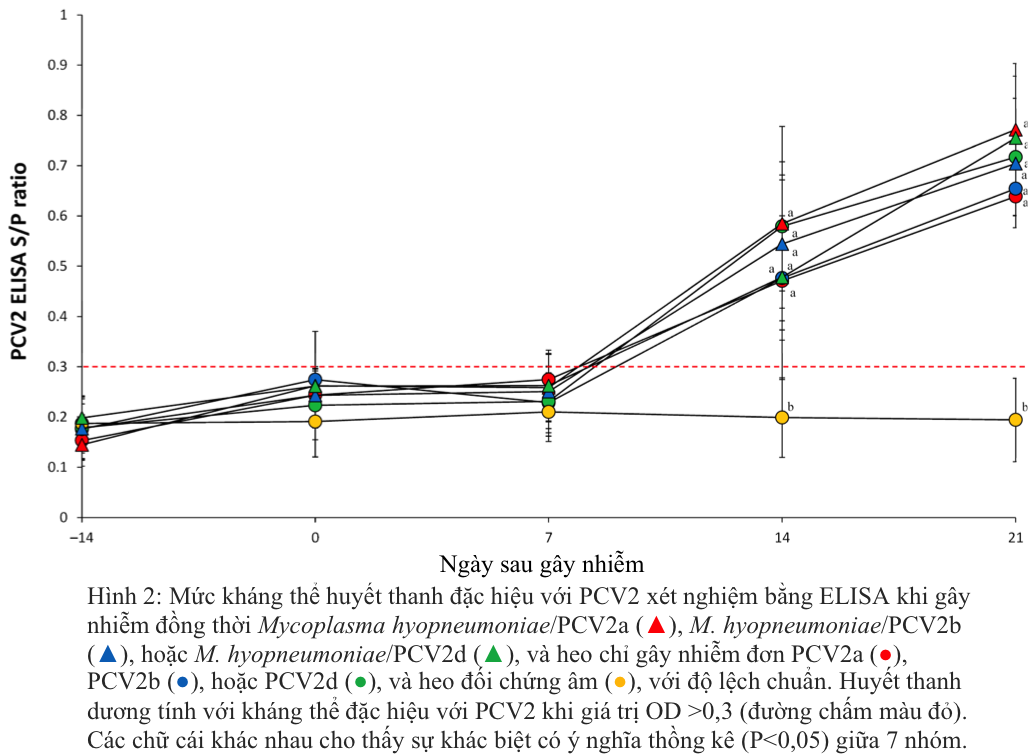
Heo bị gây nhiễm kép M. hyopneumoniae/PCV2a, M. hyopneumoniae/PCV2b và M. hyopneumoniae/PCV2d và heo bị gây nhiễm đơn PCV2a, PCV2b hoặc PCV2d có chỉ số S/P cao hơn đáng kể (p < 0,05) ở 14 và 21 sau khi gây nhiễm so với heo đối chứng âm (Hình 2). Không phát hiện được kháng thể đặc hiệu với PCV2 ở heo đối chứng âm trong suốt thời gian thí nghiệm.
- Định lượng DNA của PCV2 trong máu
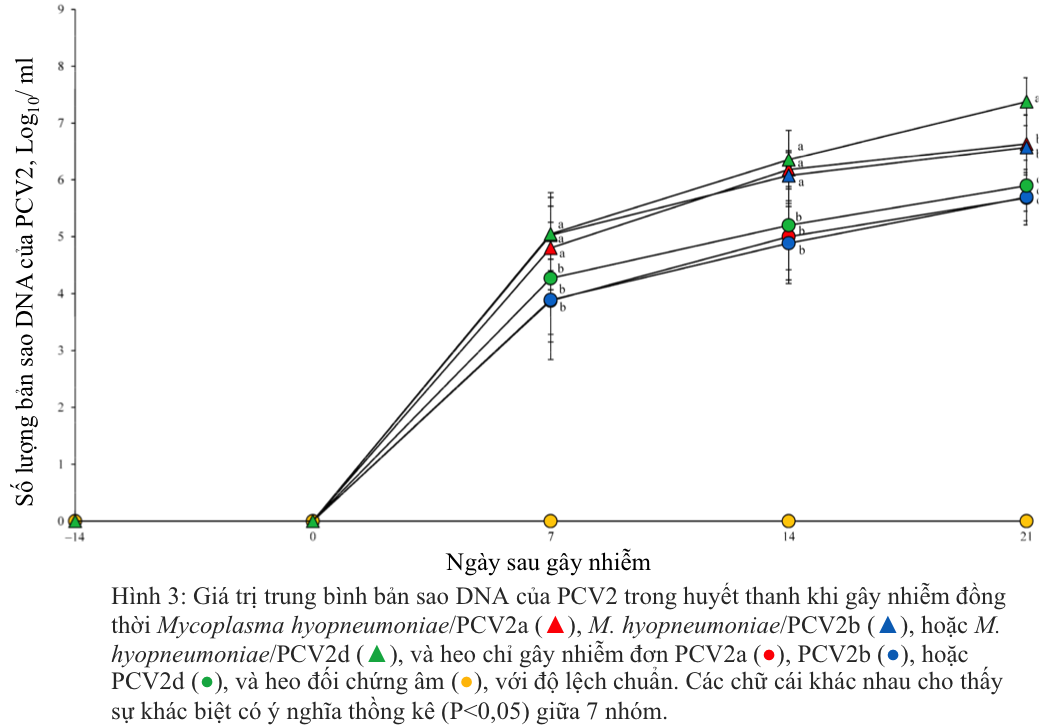
Trước khi heo bị gây nhiễm, tất cả heo ở cả bảy nhóm được thu thập mẫu huyết thanh và đều cho kết quả âm tính với PCV2a, PCV2b hoặc PCV2d. Heo bị gây nhiễm kép M. hyopneumoniae/PCV2a, M. hyopneumoniae/PCV2b hoặc M. hyopneumoniae/PCV2d có số lượng bản sao DNA của PCV2 cao hơn đáng kể (p < 0,05) so với heo bị gây nhiễm đơn lẻ PCV2a, PCV2b hoặc PCV2d ở 7 , 14 và 21 sau gây nhiễm. Heo bị gây nhiễm kép M. hyopneumoniae/PCV2d có số lượng bản sao DNA của PCV2 cao hơn đáng kể (p < 0,05) so với heo bị gây nhiễm kép M. hyopneumoniae/PCV2a hoặc M. hyopneumoniae/PCV2b ở 21 ngày sau gây nhiễm (Hình 3). Ở heo đối chứng âm DNA của PCV2 không phát hiện được trong suốt thời gian thí nghiệm.
2.5. Định lượng M. hyopneumoniae trong dịch hầu
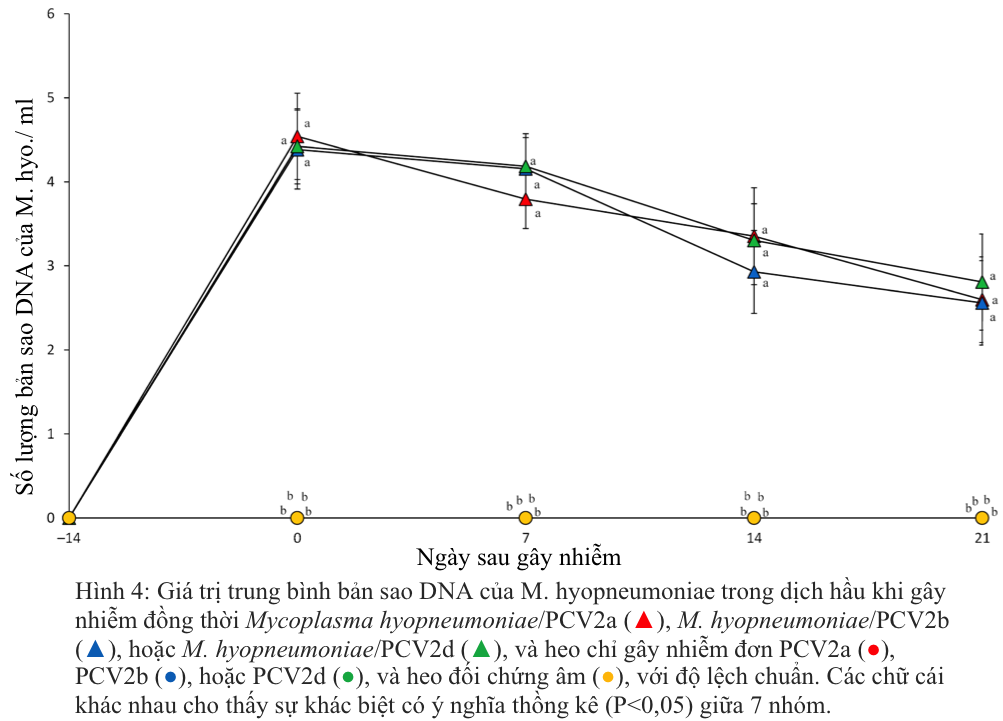
Trước khi heo bị gây nhiễm, tất cả heo ở cả bảy nhóm được thu thập mẫu huyết thanh và đều cho kết quả âm tính với M. hyopneumoniae. Trong khi đó DNA của M. hyopneumoniae đã được phát hiện ở tất cả heo bị gây nhiễm kép M. hyopneumoniae/PCV2a, M. hyopneumoniae/PCV2b hoặc M. hyopneumoniae/PCV2d trong suốt thời gian thí nghiệm. Ở heo đối chứng âm DNA của PCV2 không phát hiện được trong suốt thời gian thí nghiệm. Không có sự khác biệt đáng kể về số lượng bản sao DNA của M. hyopneumoniae được phát hiện ở heo bị gây nhiễm kép với M. hyopneumoniae/PCV2a, M. hyopneumoniae/PCV2b hoặc M. hyopneumoniae/PCV2d (Hình 4). Ở heo bị gây nhiễm đơn PCV2a, PCV2b hoặc PCV2d và ở heo đối chứng âm, DNA của M. hyopneumoniae không phát hiện được trong suốt thời gian thí nghiệm.
- Mô bệnh học
Tổn thương mô bệnh học nhẹ được ghi nhận ở heo con bị gây nhiễm đơn PCV2a, PCV2b hoặc PCV2d. Tổn thương mô bệnh học ở heo bị gây nhiễm kép M. hyopneumoniae/PCV2a, M. hyopneumoniae/PCV2b hoặc M. hyopneumoniae/PCV2d ở mức độ nghiêm trọng và lan rộng ở các hạch bạch huyết. Tổn thương chính được ghi nhận là viêm u hạt lan tỏa, rộng, chủ yếu ở các hạch bạch huyết và lách, và đôi khi ở thận. Sự xâm nhập của tế bào lympho, bạch cầu trung tính và bạch cầu ái toan đi kèm với đại thực bào ở mức độ từ vừa đến nặng. Tế bào lympho trưởng thành ở các hạch bạch huyết bị suy giảm gần như hoàn toàn, và các trung tâm mầm bị giảm hoặc không có.
Các tế bào khổng lồ đa nhân xuất hiện nhiều ở heo bị gây nhiễm kép M. hyopneumoniae/PCV2a, M. hyopneumoniae/PCV2b hoặc M. hyopneumoniae/PCV2d (Hình 5). Ở heo bị gây nhiễm kép M. hyopneumoniae/PCV2a, M. hyopneumoniae/PCV2b hoặc M. hyopneumoniae/PCV2d ghi nhận sự tăng sản mô bạch huyết quanh tiểu phế quản và quanh mạch máu ở mức độ từ trung bình đến nặng, viêm tế bào lympho ở lớp đệm của khí quản ở mức độ từ trung bình đến nặng, và tình trạng viêm hỗn hợp ở lớp đệm của khí quản. Các mẫu mô của heo đối chứng âm không ghi nhận tình trạng bất thường.

Hình 5: Các ổ u hạt đặc trưng bởi sự xâm nhập của các tế bào mô hoạt động và các tế bào khổng lồ đa nhân ở heo bị gây nhiễm kép Mycoplasma hyopneumoniae/PCV2d.
Ở 21 ngày sau gây nhiễm, heo bị gây nhiễm kép M. hyopneumoniae/PCV2a, M. hyopneumoniae/PCV2b hoặc M. hyopneumoniae/PCV2d có điểm số tổn thương vi thể ở hạch bạch huyết cao hơn đáng kể (p < 0,05) so với heo bị gây nhiễm đơn lẻ PCV2a, PCV2b hoặc PCV2d. Heo bị gây nhiễm kép M. hyopneumoniae/PCV2d có điểm tổn thương vi thể ở hạch bạch huyết cao hơn đáng kể (p < 0,05) so với heo bị gây nhiễm kép M. hyopneumoniae/PCV2a hoặc M. hyopneumoniae/PCV2b ở 21 dpi (Bảng 2).

- Hoá mô miễn dịch
Với bất kỳ kiểu gen của PCV2, tất cả heo bị gây nhiễm PCV2, đơn lẻ hoặc kết hợp với M. hyopneumoniae đều có kết quả dương tính với kháng nguyên PCV2. Kháng nguyên virus được phát hiện chủ yếu trong các đại thực bào nang ở các trung tâm mầm bị hư hại của các hạch bạch huyết. Heo bị gây nhiễm kép M. hyopneumoniae/PCV2a, M. hyopneumoniae/PCV2b hoặc M. hyopneumoniae/PCV2d có số lượng tế bào dương tính với PCV2 trên một đơn vị mô trong hạch bạch huyết cao hơn đáng kể (p < 0,05) so với heo bị gây nhiễm đơn PCV2a, PCV2b hoặc PCV2d. Heo bị gây nhiễm kép M. hyopneumoniae/PCV2d có số lượng tế bào dương tính với PCV2 cao hơn đáng kể (p < 0,05) trên một đơn vị mô trong hạch bạch huyết so với heo bị gây nhiễm kép M. hyopneumoniae/PCV2a hoặc M. hyopneumoniae/PCV2b (Bảng 2). Kháng nguyên PCV2 không phát hiện được trong bất kỳ hạch bạch huyết nào được kiểm tra từ heo đối chứng âm.
- Tương quan giữa PCV2 máu và tổn thương hạch
Mối tương quan thuận và có ý nghĩa giữa tải lượng vi rút PCV2 trong máu và mức độ nghiêm trọng của tổn thương bạch huyết đã được ghi nhận ở heo bị gây nhiễm kép PCV2 và M. hyopneumoniae (M. hyopneumoniae/PCV2a: R = 0,941, p < 0,05; M. hyopneumoniae/PCV2b: R = 0,883, p < 0,05; M. hyopneumoniae/ PCV2d: R = 0,880, p < 0,05).
3. Thảo luận
Không giống như những con heo bị nhiễm một mình PCV2, nhiễm trùng kép với M. hyopneumoniae/PCV2 dẫn đến sự biểu hiện của PCVAD với cả ba kiểu gen PCV2. Heo bị nhiễm kép M. hyopneumoniae/PCV2 đáp ứng các tiêu chí phân loại PCVAD với các dấu hiệu lâm sàng điển hình bao gồm ADWG, tổn thương bệnh lý và sự hiện diện của kháng nguyên PCV2 trong tổn thương bạch huyết. Các kết quả nghiên cứu này phù hợp với các nghiên cứu trước đây, trong đó heo bị nhiễm kép PCV2a và M. hyopneumoniae có biểu hiện lâm sàng đầy đủ của PCVAD [7]. Nghiên cứu này đã chứng minh rằng, heo nhiễm PCV2b và PCV2d khi đồng nhiễm với M. hyopneumoniae cũng có thể phát triển thành PCVAD (cùng với PCV2a đã được xác nhận trước đó).
Trong nghiên cứu này, M. hyopneumoniae rõ ràng có khả năng gây ra bệnh liên quan đến PCV2 ở heo bị nhiễm trùng kép. Tuy nhiên, cơ chế cụ thể mà M. hyopneumoniae tăng cường các tổn thương liên quan đến PCV2 vẫn chưa được xác định. M. hyopneumoniae được coi là một mầm bệnh ngoại bào và vị trí nhiễm trùng chủ yếu giới hạn ở phổi và lông rung của các tế bào biểu mô phế quản và phế quản [9,10]. Tuy nhiên, đôi khi M. hyopneumoniae cũng có thể phân lập được từ mẫu gan, lá lách, thận và các hạch bạch huyết phế quản của heo bị nhiễm M. hyopneumoniae trong thực nghiệm [11,12].
Phản ứng viêm, một dấu hiệu đặc trưng của nhiễm trùng phổi do M. hyopneumoniae gây ra, có thể là một cơ chế then chốt do PCV2 gây ra, tạo điều kiện cho vi khuẩn xâm nhập và sống sót trong các đại thực bào phế nang để tiếp tục lan truyền đến gan, lá lách, thận và hạch bạch huyết [ 11,12,13]. Do đó, có khả năng PCV2 và M. hyopneumoniae tương tác với nhau trong cùng một đại thực bào hoặc đại thực bào bị nhiễm lân cận, thúc đẩy mức độ nhân lên mạnh của PCV2 trong các mô bạch huyết.
Heo bị nhiễm kép M. hyopneumoniae/PCV2d có lượng PCV2 trong máu và hạch bạch huyết với các tổn thương bạch huyết nghiêm trọng hơn, ở 21 ngày sau gây nhiễm, cao hơn đáng kể khi so sánh với heo bị nhiễm kép M. hyopneumoniae/PCV2a hoặc M. hyopneumoniae/PCV2b. Tuy nhiên, không có sự khác biệt đáng kể về huyết thanh học, mức tải lượng PCV2 trong máu ở các thời điểm khác và ADWG giữa các kiểu gen PCV2 ở heo bị nhiễm kép M. hyopneumoniae và PCV2. Hiện tại không thể giải thích một cách hoàn toàn chắc chắn lý do tại sao M. hyopneumoniae có khả năng kích hoạt sự nhân lên của PCV2d nhiều hơn các kiểu gen PCV2 khác, dẫn đến mức độ tổn thương bạch huyết nghiêm trọng hơn. Sự lây nhiễm kép này được thực hiện tuần tự, đó là nhiễm M. hyopneumoniae trước, sau đó 14 ngày mới gây nhiễm PCV2 [7].
Ở heo nhiễm M. hyopneumoniae, các tế bào dương tính với interferon-γ (IFN-γ) được phát hiện ở 7 ngày sau gây nhiễm, tăng lên ở 14 và 21 ngày sau gây nhiễm, và giảm nhẹ sau đó [14]. IFN-γ được gọi là cytokine tiền viêm và tăng cường sự nhân lên của PCV2 [15]. PCV2d có thêm một axit amin (lysine) trong protein capsid được mã hóa bởi ORF2 so với PCV2a và PCV2b. Đặc biệt, protein capsid của PCV2 tham gia vào việc tăng cường sự nhân lên của virus trong điều kiện phòng thí nghiệm [16].
Hơn nữa, heo bị nhiễm PCV2d thực nghiệm có nồng độ PCV2 trong máu cao hơn và mức độ tổn thương bạch huyết nghiêm trọng hơn so với heo bị nhiễm PCV2a hoặc PCV2b thực nghiệm [17]. Người ta suy đoán rằng, sự khác biệt di truyền giữa PCV2d và PCV2a/PCV2b có thể làm tăng khả năng nhân lên của PCV2d trong các điều kiện bệnh lý do nhiễm M. hyopneumoniae gây ra. Các nghiên cứu bổ sung là cần thiết để làm sáng tỏ sự nhân lên của PCV2d được tăng cường khi nhiễm M. hyopneumoniae.
Thử nghiệm này nhằm so sánh độc lực giữa ba kiểu gen của PCV2. Do đó, M. hyopneumoniae được sử dụng đơn thuần như một đồng yếu tố để gây ra biểu hiện đầy đủ của PCVAD. Ngoài ra, không có sự khác biệt đáng kể về nồng độ của M. hyopneumoniae ở thanh quản của heo bị nhiễm kép M. hyopneumoniae/PCV2a, M. hyopneumoniae/PCV2b hoặc M. hyopneumoniae/PCV2d. Vì tác động của PCV2 đối với M. hyopneumoniae không được xác định trong nghiên cứu này, nên không cần thiết phải đưa vào thử nghiệm những con heo bị nhiễm M. hyopneumoniae đơn lẻ, để tránh việc sử dụng heo một cách không cần thiết. Cần có các nghiên cứu sâu hơn để xác định ảnh hưởng của PCV2 đối với M. hyopneumoniae bao gồm cả nhóm nhiễm M. hyopneumoniae
Đây là nghiên cứu so sánh khả năng gây bệnh và độc lực đầu tiên của các kiểu gen PCV2a, PCV2b và PCV2d gây nhiễm thực nghiệm trên heo không nhiễm và đồng nhiễm với M. hyopneumoniae. Kết quả của nghiên cứu này có ý nghĩa lâm sàng vì PCV2d là kiểu gen chiếm ưu thế trong quần thể heo châu Á và Bắc Mỹ [13,18,19,20,21,22]. Nhiễm chủng PCV2d của Trung Quốc có thể dẫn đến bệnh nặng hơn so với nhiễm PCV2a hoặc PCV2b [17]. Ngược lại, các chủng phân lập ở Hàn Quốc và Bắc Mỹ, ở cả ba kiểu gen PCV2 (a, b và d) đều chưa ghi nhận sự khác biệt đáng kể về độc lực [23,24]. Nghiên cứu này được thực hiện chỉ với một chủng virus cho mỗi kiểu gen PCV2, và như vậy sự khác biệt về độc lực có thể chỉ do chủng chứ không phải kiểu gen. Do đó, cần thận trọng trong giải thích độc lực của PCV2 khi so sánh giữa ba kiểu gen. Cần có các nghiên cứu sâu hơn để so sánh độc lực với các chủng khác nhau của cả 3 kiểu gen PCV2a, PCV2b và PCV2d.
4. Vật liệu và phương pháp
4.1 Vật nuôi
Bốn mươi hai con heo khỏe mạnh về mặt lâm sàng, đã được bú sữa non từ những con heo nái chưa được tiêm phòng PCV2 trước đó, được mua lúc 28 ngày tuổi từ một trang trại thương mại không nhiễm PRRSV, Mycoplasma hyopneumoniae, dựa trên xét nghiệm huyết thanh học, lịch sử giết mổ và lâm sàng lâu dài. Trang trại có huyết thanh dương tính với PCV2 nhưng không có biểu hiện PCVAD. Heo có huyết thanh âm tính với PRRSV (HerdChek PRRS X3 Ab test, IDEXX Laboratories Inc., Westbrook, ME, USA), PCV2 (INgezim CIRCO IgG, Ingenasa, Madrid, Spain) và M. hyopneumoniae (M. hyo, xét nghiệm Ab, IDEXX Laboratories Inc).
Những con heo được chọn trong thí nghiệm âm tính với PCV2 (a, b, và d), PRRSV trong máu, và M. hyopneumoniae ở hầu, được kiểm tra bằng bằng realtime PCR [25,26,27,28] khi đến nơi.
4.2 Bố trí thí nghiệm
Heo được phân thành 7 nhóm (6 heo mỗi nhóm) bằng cách sử dụng chức năng tạo số ngẫu nhiên từ Excel (Microsoft Corporation, Redmond, WA, USA) (Bảng 1). Số lượng mẫu tối thiểu cho mỗi nhóm được tính bằng cách sử dụng gói pwr trong phiên bản R 4.1.0 (Nhóm R Core: ngôn ngữ và môi trường cho tính toán thống kê. R Foundation for Statistical Computing, Vienna, Austria, http://www.r.project .org, truy cập ngày 25 tháng 7 năm 2021). Mức ý nghĩa 0,05, biên độ hiệu ứng 0,4 và hiệu suất 70% được sử dụng để tính toán số lượng heo con tối thiểu cần thiết cho mỗi nhóm. Giá trị này được xác định là 5,67, do đó, ít nhất sáu con heo được chỉ định cho mỗi nhóm.
Heo trong mỗi nhóm được phân ngẫu nhiên vào bảy phòng riêng biệt. Ở 14 ngày sau gây nhiễm (28 ngày tuổi), heo trong ba nhóm M. hyopneumoniae/PCV2 được tiêm bắp với hỗn hợp xylazine hydrochloride 2,2 mg/kg (Rompun, Bayer Healthcare, Shawnee Mission, KS, USA), 2,2 mg /kg tiletamine hydrochloride và 2,2 mg/kg zolazepam hydrochloride (Zoletil 50, Virbac, Carros, Pháp). Heo sau đó bị gây nhiễm trong khí quản 7 mL môi trường nuôi cấy M. hyopneumoniae (chủng SNU98703) chứa 107 đơn vị đổi màu (color changing units – CCU)/mL. Chủng M. hyopneumoniae (chủng SNU98703) đã được xác định là chủng vi khuẩn gây viêm phổi [29].
Ở 0 ngày sau gây nhiễm (42 ngày tuổi), heo trong ba nhóm M. hyopneumoniae/PCV2 bị g6y nhiễm trong mũi mỗi heo 3 mL PCV2a (chủng SNUVR100032, cấy truyền đời thứ 5 trong môi trường tế bào PK15 không nhiễm PCV, dòng tế bào PK15 không nhiễm PCV được được cung cấp bởi WOOGENE B&G Ltd., Seoul, Hàn Quốc), PCV2b (chủng SNUVR202155, cấy truyền đời thứ 5 trong môi trường tế bào PK15 không nhiễm PCV) hoặc PCV2d (chủng SNUVR202003, cấy truyền đời thứ 5 trong môi trường tế bào PK15 không nhiễm PCV), dịch virus chứa 1,2 × 105 50% liều gây nhiễm tế bào 50% (TCID50/mL), theo từng nhóm tương ứng. Heo trong các nhóm PCV2a, PCV2b và PCV2d bị gây nhiễn trong mũi lần lượt 3 mL PCV2a, PCV2b và PCV2d như đã đề cập ở trên. Heo trong nhóm đối chứng âm tính bị gây nhiễm trong mũi 3 mL dung dịch muối đệm phốt phát (PBS, 0,01M, pH 7,4).
Mẫu máu được thu thập từ mỗi con heo tại tĩnh mạch cổ ở −14, 0, 7, 14 và 21 ngày sau gây nhiễm. Heo được gây mê bằng cách tiêm tĩnh mạch natri pentobarbital và sau đó được cho điện giật ở 21 ngày sau gây nhiễm như đã mô tả trước đây [30]. Mẫu mô cơ quan được thu thập từ mỗi con heo khi mổ khám tử.
4.3 Đánh giá lâm sàng
Heo được theo dõi các dấu hiệu lâm sàng hàng ngày và được chấm điểm hàng tuần bằng cách sử dụng hệ thống xếp hạng điểm số từ 0 (bình thường) đến 6 (khó thở nặng và thở bụng) [31]. Tất cả những người quan sát tham gia vào các quá trình này đều không được biết về loại virus, vi khuẩn gây nhiễm.
4.4 Năng suất tăng trưởng
Trọng lượng sống của mỗi con heo được đo ở 28 ngày tuổi (−14 ngày sau gây nhiễm) và 63 ngày tuổi (21 ngày sau gây nhiễm). ADWG được phân tích trong khoảng thời gian từ 28 đến 63 ngày tuổi. ADWG trong các giai đoạn sản xuất khác nhau được tính bằng chênh lệch giữa trọng lượng ban đầu và trọng lượng cuối cùng chia cho số ngày của giai đoạn thử nghiệm.
4.4 Định lượng DNA của PCV2
Mẫu huyết thanh từ heo của tất cả các nhóm thử nghiệm được thu thập ở −14, 0, 7, 14 và 21 sau khi gây nhiễm. Sử dụng kit thương mại (QIAamp DNA Mini Kit, QIAGEN, Valencia, CA, USA) để trích xuất DNA của PCV2từ các mẫu huyết thanh. Số bản sao DNA của PCV2a, PCV2b và PCV2d được định lượng bằng realtime PCR [25,26].
4.5 Định lượng M. hyopneumoniae trong dịch hầu
Mẫu tăm bông dịch hầu từ heo của tất cả các nhóm thử nghiệm được thu thập ở −14, 0, 7, 14 và 21 sau khi gây nhiễm. Sử dụng kit thương mại (QIAamp DNA Mini Kit, QIAGEN) để trích xuất DNA M. hyopneumoniae từ dịch thanh quản. Số lượng bản sao DNA của M. hyopneumoniae sau đó được định lượng bằng realtime PCR [27].
4.6 Huyết thanh học
Mẫu huyết thanh cũng được kiểm tra kháng thể chống lại PCV2 (INgezim CIRCO IgG, Ingenasa). Các mẫu huyết thanh được coi là dương tính với kháng thể PCV2 nếu mật độ quang học (OD) lớn hơn 0,3 theo hướng dẫn của nhà sản xuất.
4.8 Mô bệnh học
Để phân tích những thay đổi mô bệnh học ở các hạch bạch huyết bẹn nông, ba mẫu cắt vi thể của hạch bạch huyết được mã hoá và kiểm tra [32]. Hạch bạch huyết được đánh giá sự suy giảm mô bạch huyết và viêm, và cho điểm từ 0 đến 5 (0 = bình thường; 1 = suy giảm mô bạch huyết nhẹ; 2 = suy giảm mô bạch huyết nhẹ đến trung bình và thay thế mô bào; 3 = suy giảm mô bạch huyết tràn lan vừa và thay thế mô bào; 4 = suy giảm mô bạch huyết trung bình đến nặng và thay thế mô bào; 5 = suy giảm mô bạch huyết nghiêm trọng và thay thế mô bào).
4.9 Hoá mô miễn dịch
Xét nghiệm hóa mô miễn dịch (IHC) và phân tích hình thái của IHC được thực hiện như mô tả trước đây [33]. Tín hiệu dương tính được định lượng bằng chương trình NIH Image J 1.45s (//imagej.nih.gov/ij/download.html, truy cập vào ngày 12 tháng 7 năm 2021). Đối với mỗi mẫu mô hạch bạch huyết, 10 hiển vi trường được quan sát ngẫu nhiên và số lượng tế bào dương tính trên một đơn vị diện tích (0,25 mm2) được đếm và tính toán giá trị trung bình [33].
4.10 Phân tích thống kê
Trước khi phân tích thống kê, dữ liệu realtime PCR được chuyển đổi log để giảm phương sai và độ lệch dương. Dữ liệu được kiểm tra theo phân phối bình thường bằng cách sử dụng phép tính Shapiro–Wilk. Phân tích phương sai một chiều (ANOVA) được sử dụng để kiểm tra sự khác biệt thống kê giữa bảy nhóm cho từng thời điểm. Nếu kết quả kiểm tra ANOVA một chiều cho thấy có ý nghĩa thống kê, tiến hành so sánh theo cặp với hiệu chỉnh Tukey. Nếu giả định chuẩn không được đáp ứng, trắc nghiệm Kruskal–Wallis sẽ được thực hiện. Nếu kết quả từ trắc nghiệm Kruskal–Wallis cho thấy có ý nghĩa thống kê, trắc nghiệm Mann–Whitney với sự hiệu chỉnh Tukey được thực hiện để so sánh sự khác biệt giữa các nhóm. Tương quan Spearman (các biến số không phân bố chuẩn) được áp dụng để xác định mối quan hệ giữa nồng độ PCV2 trong máu và mức độ nghiêm trọng của các tổn thương bạch huyết. Kết quả được xem là có khác biệt thống kê khi giá trị của p <0,05.
Tác giả: Oh T, Suh J, Park KH, Yang S, Cho H, Chae C. A Comparison of Pathogens. 2021 Aug 3;10(8):979




